0.01mol/Lの酢酸CH3COOHのpHとして最も近いものはどれか?ただし、CH3COOHの電離度は0.01とする。
- 4
- 5
- 6
- 8
- 9
解答は①です。
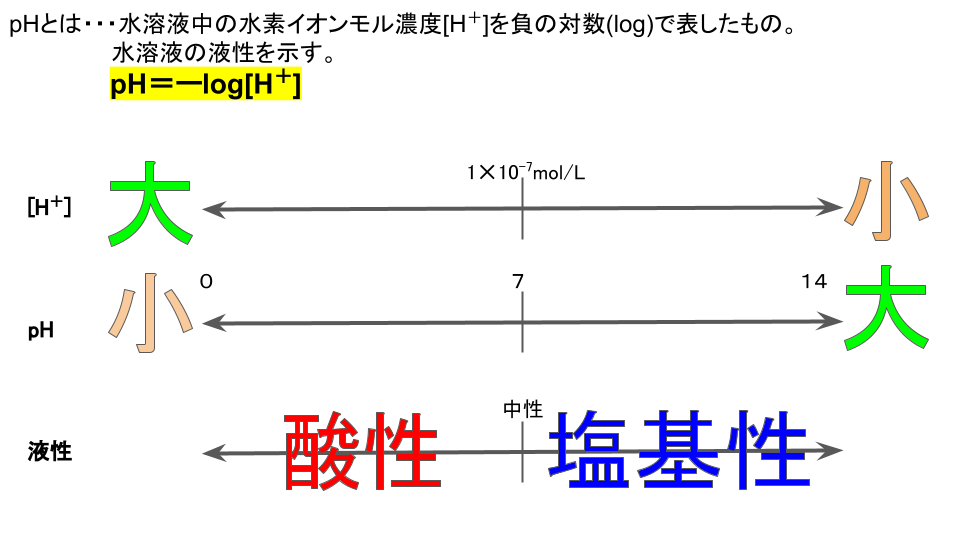
pHとは、水素イオン指数のことで、水溶液の液性を表します。
水溶液の液性は、水溶液中の水素イオン(H+)のモル濃度で決まります。
今回の問題の場合、CH3COOHのH+のモル濃度は以下の式で表すことができます。
[H+]=c ✕ m ✕ α = 1✕10-2 ✕ 1 ✕ 0.01 = 1 ✕ 10-4
pH=ーlog[H+]の式に当てはめると、
pH=ーlog(1✕10-4)=4
となります。
したがって今回の問題の回答は①4となります。
詳しい解説は以下をご覧ください。
 pH計算の解説
pH計算の解説 私が実践していた勉強方法がこちらです。
 万人にオススメ!無駄を削いだ勉強方法
万人にオススメ!無駄を削いだ勉強方法 参考になる部分がありましたら是非実践してみていただけたらと思います。
最後までご覧いただきありがとうございました。

